Frist Wave BioPharma(FWBI), Inc 의 전망
바이오 제약 산업은 특히 위장관(GI) 질환 분야에서 역동적이고 지속적으로 발전하고 있는 현재 Frist Wave BioPharma(FWBI)는 위장관(GI) 질환의 대한 표적 비전신 요법 개발을 전문으로 하는 임상단계 바이오 제약 회사로 2상 임상 프로그램까지 좋은 결과를 도출해 냈기 때문에, 3상 임상실험으로 넘어갈 전망이고 결과에 따라서 상당한 이윤을 남길 수 있기 때문에 투자를 고려해볼 종목이지만 상당한 위험 역시 동반하기에, 과한 투자 보다는 보수적으로 접근하는 것이 좋다고 생각합니다.
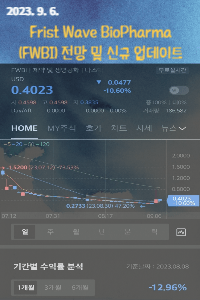
Frist Wave BioPharma(FWBI), Inc 라는 기업은
Frist Wave BioPharma는 위장관(GI) 질환의 대한 표적 비전신 요법 개발을 전문으로 하는 임상단계 바이오 제약 회사입니다. 회사는 현재 지방과 기타 영양소의 소화를 가능하게 하도록 설계된 재조합 리파이제 효소인 생물학적 아드루리피아제와 항염증증 작용을 하는 경구 소분자 니클로사마이드라는 두 가지 독점 기술을 기반으로 구축된 여러 임상 단계 프로그램으로 치료제 개발 파이프라인을 진행하고 있습니다. 염증성 First Wave는 낭포성 섬유증(CF) 및 만성 췌장염(CP) 환자의 외분비 췌장 기능 부전(FW-EPI) 치료를 위해 Adrulipase를 중심으로 구축된 2개의 2상 임상 프로그램을 준비하고 있습니다.
Adrulipase를 개발함에 있어서 First Wave는 CF 및 CP 환자에게 비동물 유래 EPI를 제어하기 위한 안전하고 효과적인 치료법을 제공하고 일일 알약 부담을 극적으로 줄일 수 있는 잠재력을 제공하고자 합니다. 회사는 또한 궤양성 직장염 및 궤양성 직장구불결장염에 대한 FW-UP, 궤양성 대장염에 대한 FW-UC, 크론병에 대한한 FW-CD를 포항하여 니클로사미드와 관련된 여러 프로그램을 진행하고 있습니다. Frist Wave BioPharma는 플로리다주 보카레이톤에 본사를 두고 있습니다.
Adrulipase 란?
Adrulipase는 낭포성 섬유증(CF) 및 만성 췌장염(CP과 완련된 외분비성 췌장 기능 부전(EPI)의 치료를 위해 경구 비전신 생물학적 캡슐로 투여되는 재조합 리파제 효소입니다. Adrulipase는 Yarrowia lipolytica 에서 파생됩니다.
효모 리파아제이며 EPI 환자의 화관에서 지방 분자를 해석하여 영양소로 흡수될 수 있도록 설계되었으며, EPI는 외분비 췌장 효소를 결핍을 특징으로 하는 상태로, 환자가 음식을 적절하게 소화할 수 없거나 소화 불량을 초래합니다. 이 효소의 결핍은 지방성 설사, 배변 충동 및 체중 감소의 원인이 될 수 있습니다. 낭포성 섬유증 재단(Cystic Fibrosis Foundation)에 따르면 미국에는 낭포성 섬유증으로 인한 EPI 환자가 약 40,000명 국립 췌장 재단(National Pancreas Foundation)에 따르면 미국에는 만성 췌장염으로 인한 EPI 환자가 약 95,000명 있다고합니다
향상된 Adrulipase 제제를 조사하는 2상 SPAN 임상 시험의 초기 주요 결과 발표
보카 라톤, 플로리아 23. 7.13. – Frist Wave BioPharm, Inc., (NSADAQ:FWBI),(“First Wave BioPharma” 또는 “회사”), 표적 치료제 개발을 전문으로 하는 임상 바이오 제약 회사 위장(GI) 질환에 대한 비전신 요법, 오늘 회사의 2상 SPAN 임상 시험에서 최상위 결과를 받았다고 발표했습니다.
낭포성 섬유증(CF) 환자의 외분비성 췌장 기능 부전(EPI)치료를 위한 Adrulipase의 향상된 장용 미세과립 전달 제제를 조사합니다. 연구의 초기 데이터에 따르면 강화된 Adrulipase 제제는 안전하고 내약성이 우수하며 이전 Adrulipase 제제보다 개선된 것으로 나타났습니다.
하지만 예비 데이터는 또한 1차 유효성 종점이 달성되지 않았을 가능성이 있음을 나타내며 Frist Wave BioPharm는 계속해서 데이터를 평가하고 있으며 약 8주 내에 1차 및 2차 평가변수에 대한 추가 겨로가를 보고 할 것으로 예상합니다.
Frist Wave BioPharma(FWBI)의 2상 SPAN 임상 시험
해당 임상시험은 13명의 환자를 대상으로 적정 용량증량 Adrulipase에 대한 장용 미세과립 전달 제형의 안전성, 내약성 및 효능을 조사하기 위해 설계되었습니다.
1차 유효성 좀점은 지방 흡수 계수(CFA)이며, 2차 종점은 대변 무게, 흡수 장애의 징후 및 증상, 질소 흡수 계수(CNA)입니다.
Frist Wave BioPharm는 초기안전성 및 유효성 결과를 기반으로 미국 식품의약국(FDA)과 임상 2상 종료 회의를 진행하여 데이터를 검토하고 등록 3상 임상 시험을 위한 매개변수를 논의할 계획입니다.
BLA(Biologics License Application)의 요건을 충족해야 합니다. Frist Wave BioPharm는 23. 4분기에 End-of-Phase 2 회의를 진행할 것으로 예상합니다.
Frist Wave BioPharma(FWBI)의 사장 겸 CEO James Sapristein의 한마디.
제 2상 SPAN 임상 시험의 예비 데이터는 Adrulipase의 강화된 미세과립 전달 제형이 안전하고 내약성이 우수함을 나타냅니다. 우리는 데이터 세트를 분석하는 과정에 있으며 9월 기간에 1차 및 2차 종점에 대한 최상위 검토가 있을 것으로 예상합니다. 또한 연구 참여를 자원한 환자드로가 임상시험이 완전히 등록되고 제시간에 완료될 수 있도록 해준 3개 참여 임상시험 현장의 조사관과 직원들에게 감사드린다고 덧붙였습니다.
다른 투자종목이 필요하다면
- 2025 NASDAQ:CMCT 주가(Creative Media & Community Trust) 크리에이티브 미디어 앤 커뮤니티 트러스트 주식 로스앤젤레스 에코 파크 지역에 36세대 아파트 1915 Park 완공 발표
- 2025 NASDAQ:PMAX 주가(Powell Max), 파웰 맥스 주식 상반기 미감사 재무 결과 발표
- 2025 NASDAQ:QLGN 주가(Qualigen Therapeutics) 퀄리겐 테라퓨틱스 주식 나스닥 커뮤니케이션 및 상장 지속 현황에 대한 업데이트 제공
- 2025 NASDAQ:EVAX 주가(Evaxion Biotech A/S) 에바종 바이오테크 ADR 주식 MSD에 백신 후보물질 EVX-B3 라이선스 아웃
- 2025 NASDAQ:EPOW 주가(Sunrise New Energy) 선라이즈 뉴 에너지 주식 첨단 흑연 및 탄소 소재 혁신을 위한 국가 과학기술개발기금 59만 달러 지원금 수상